テクノロジーTECHNOLOGY
近年の技術の発展により、多能性幹細胞やヒト由来の細胞を用いて多様な細胞や組織を作ることが可能になりました。しかし、実用化に向けては、目的に適した機能的な細胞・組織をどのように作るか、また、それらの細胞・組織の機能をどのように評価するかという課題が残されています。
当社は、細胞の3次元培養によって生体模倣性が高い細胞・組織を作製し、それらの細胞・組織の機能を評価する手法をあわせて提供することで、基礎研究、創薬、再生医療、化粧品といった幅広い分野への貢献を目指しています。
はじめに:3次元培養とは
3次元培養とは、細胞の多層化や細胞塊の形成等で立体的な環境において細胞を培養する手法を指します。細胞培養プレートなどの平面上で細胞を単層培養する2次元培養に比べて、より生体に近い環境を創り出すことができるため、細胞の生理学的機能の再現性を高めることができるとされています。
表1.2次元培養と3次元培養の比較
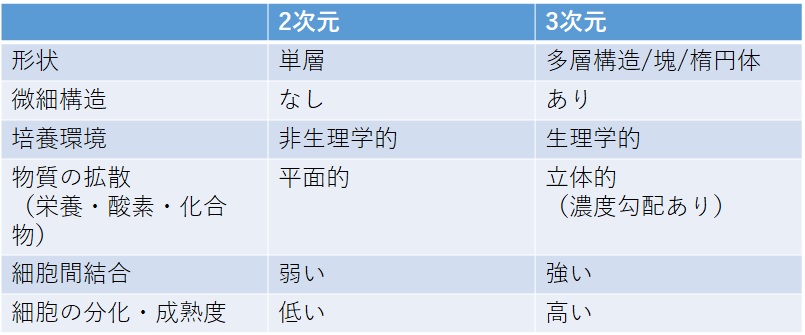
宮本ら, Organ Biology 27: 37-52 (2020) を参考にSCADで作成
当社の3次元培養技術
当社は、3次元培養の手法として、①配向性ファイバー足場を用いた細胞の多層化、②ヒドロゲルを用いた細胞の自己組織化の2種を主に用いています。
1. 配向性ファイバー足場を用いた細胞の多層化
緻密に配向制御したファイバーシートを足場に用いて細胞を培養することで、細胞がファイバーの方向に沿って整列した多層の細胞シートを作ることができます。例えば、神経細胞を用いた場合、ファイバーシートの上下に細胞が積み重なった50~100 μmの厚みを持つ細胞シートが得られます。当社技術を用いて作製した多層構造の神経細胞シートには、① 3次元構造の高密度培養により成熟化が促進される、② 足場への良好な接着により細胞の凝集を抑制して長期間安定的に培養できる等、2次元培養と比べて優れた特長があります。
(a) 配向性ファイバー足場による配向制御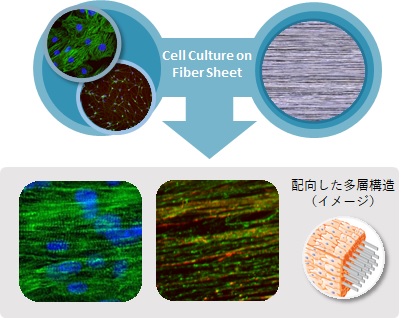
(b) 神経細胞の多層化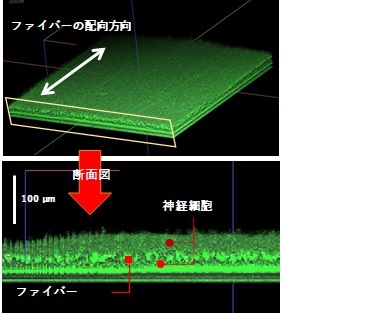
図1 配向性ファイバーシートを用いた3次元培養
2. ヒドロゲルを用いた細胞の自己組織化
ヒドロゲルを含む培地中で細胞を培養することで細胞の遊走と配向を制御し、細胞が自己組織化した組織片を作ることができます。特定の培養条件の下、2本の支柱を備えた容器内で骨格筋芽細胞を培養することで、支柱を架橋するような形でミリメーターサイズの骨格筋組織が得られます。得られた骨格筋組織は刺激に応答して収縮し、後に述べる定量的な骨格筋収縮力の評価に最適です。
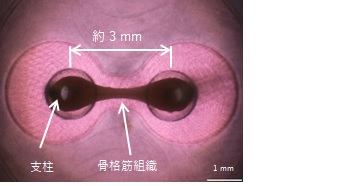
図2 骨格筋組織の3次元培養
「細胞デバイス」
当社は、細胞や組織の培養および機能評価のための用具や容器を独自に開発・製造しています。例えば、先に述べたような配向性ファイバー足場や多層化した細胞シートはごく薄く柔らかいため、ピンセット等で取り扱うのには不向きです。また、観察・計測に用いられる装置によっては一般的な培養容器とは異なる専用の測定プローブが用いられることもありますが、このような場合、装置専用の測定プローブを用いて細胞培養を行う必要があり、汎用性やコストの問題が生じます。
これらの課題を解決するものとして、当社は、各種の培養容器や測定装置の間の移動を自在に行えるような小型の細胞培養容器を開発しました。さらに、その容器自体に細胞の機能評価に適した構造上の工夫を施しています。例えば、細胞の多層化を行うには、配向性ファイバーシートを96ウェルプレートに収まるような小型のフレームに保持させた配向性ファイバーデバイスが適しています。また、筋組織の収縮性評価用には、骨格筋組織の支持と収縮力の計測の両方に働くものとして、柔軟性のある支柱を内部に備えた培養容器を開発しました。
細胞の培養と評価の機能を兼ね備え、細胞チップ/組織チップへの拡大も可能なことから、当社はこれらを「細胞デバイス」と名付けました。微細加工やプラスチック成形の技術を基盤として、素材の選択から形状のデザインまで社内で実施する能力を備えており、目的や対象に応じて柔軟に設計・試作を行うことができます。
(a) ファイバーデバイスの例

(b) ファイバーデバイスの断面図(イメージ)
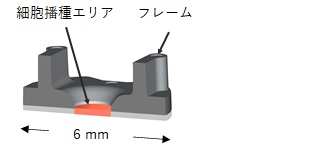
(c) 骨格筋細胞デバイス(イメージ)
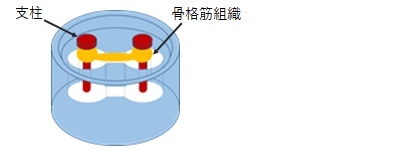
図3 細胞デバイスの例
3次元培養技術を活かした機能試験法の開発
当社は、3次元培養技術と細胞デバイスの特長を活かした細胞・組織の機能試験法の開発にも取り組んでいます。特に、標的の細胞・組織が生体内で果たしている機能(例:神経伝達、筋の収縮等)を、細胞が生きた状態で定量的に評価することができる高次の機能試験によって、従来の試験法では得られない価値の提供を目指しています。
1. 神経細胞デバイス:電気生理学的特性の評価
神経細胞の役割は電気的な信号の出力と伝達にあることから、神経細胞の機能の異常やその回復を評価するには、神経における電気活動の異常やその抑制・回復を電気生理学的に測定することが重要です。近年注目を浴びているin vitro電気生理試験法の一つに多電極アレイ(Multi-Electrode Array;MEA)を用いた細胞外電位の計測があります。
MEAには微小電極がアレイ状に配置されており、細胞集団の細胞外電位を同時かつ連続的に観測することができるため、神経ネットワーク活動の評価に適しています。しかし、iPS細胞から分化誘導した神経細胞を用いる場合、神経ネットワークの形成に長期間の培養期間を要する上に、培養中に神経細胞が容器から剥がれて凝集してしまうために望みの結果が得られないという問題がしばしば生じます。当社の3次元培養技術を用いて作製した多層構造の神経細胞シートはこれらの問題を解決し、MEAを用いた神経の電気生理学的特性の評価の実用性を大きく高めます。
また、MEAを用いた細胞外電位の計測は、スパイク数、同期バースト発火頻度、同期バースト持続時間等、多数の解析パラメータを与えます。被験物質の作用機序によって影響が生じる解析パラメータが異なるため、神経毒性の有無や神経障害の治療効果を判定するには多次元データの解析が必要です。当社および当社の3次元培養神経デバイスは、主成分分析や階層化クラスタリングによる多次元解析に対応しています。

図4 SCAD神経細胞デバイスの特長(3次元培養による早期成熟化)
2. 骨格筋組織片の収縮性の評価
骨格筋はその収縮によって身体を支え動かすという重要な役割を担っています。骨格筋機能の不全を細胞や組織で再現しようとする試みが国内外で行われていますが、2次元培養では生体内の筋管細胞の特性(分化、配向性構造等)を十分に再現できない上、遺伝子・タンパク質の発現量や組織サイズの計測から骨格筋の収縮力を予測するのは容易ではないという問題があります。
当社の技術を用いて作製した3次元構造の骨格筋組織片は電気刺激に応答して収縮し、その収縮力を定量的に評価することが可能です。さらに、当社は、骨格筋組織片の培養と収縮力の評価を同時に行うことができる機能的な骨格筋デバイスを開発しました。
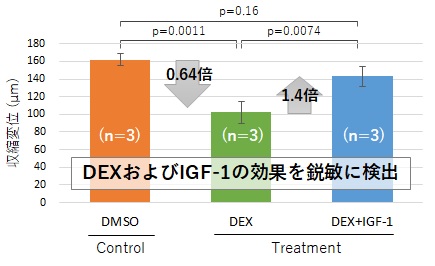
例えば、マウス筋芽細胞であるC2C12細胞から作製した骨格筋デバイスを用いることで、デキサメタゾン(DEX)添加による筋収縮力の低下がIGF-1の添加によって回復することを簡便なin vitro試験で短期間かつ高感度で評価することができます。
(a) 薬剤添加48h後の収縮変位
(b) 収縮変位の経時的変化
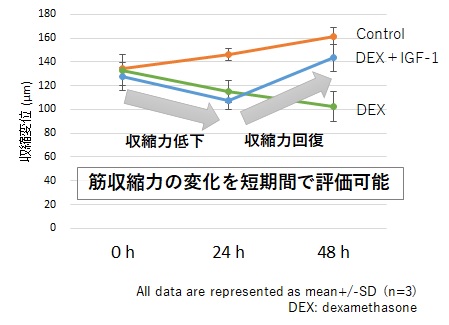
図5 SCAD骨格筋デバイスの応用例(マウス筋芽細胞を用いた骨格筋収縮力評価)
3. 神経筋接合部モデルの開発
生体内では、骨格筋は運動神経の支配を受けており、運動神経終末から放出される神経伝達物質を骨格筋上の受容体が受け取ることで筋収縮が引き起こされます。神経と筋肉の接続部を神経筋接合部といいますが、神経筋接合部の障害は筋力の低下や筋委縮を引き起こし、運動機能の低下に加えてさらに重症になると呼吸筋の障害により生命にかかわる事態を生じます。
神経筋接合部に関わる代表的な疾患には重症筋無力症がありますが、そのほかにも筋ジストロフィー、筋委縮性側索硬化症(ALS)や加齢性筋肉減少症等の多様な神経筋疾患に関与しているとされています。当社は、神経細胞と骨格筋細胞の3次元培養と機能試験法の技術を活かして、神経筋接合部モデルの開発にも取り組んでいます。
疾患特異的iPS細胞の利用と疾患モデルの開発
iPS細胞および関連技術の発展により、患者様の体細胞から作製したiPS細胞(疾患特異的iPS細胞)と分化細胞を用いて、疾患の原因や進行状態の解明(病態の解明)や治療薬候補の探索を行う動きが国内外で急速に進展しています。遺伝性の難治性疾患が多い神経筋疾患領域は、疾患の原因遺伝子の異常やその他の背景因子を併せ持つ疾患特異的iPS細胞の意義が特に大きい分野です。
当社は、現在、京都府立医科大学との共同研究のもとにシャルコー・マリー・トゥース病の疾患モデルの開発に取り組んでいます。シャルコー・マリー・トゥース病は遺伝性の神経筋疾患であり、末梢神経の障害により運動機能障害や感覚障害が引き起こされます。遺伝性の末梢神経障害の中で患者数が最も多く、厚生労働省の指定難病の一つに指定されていますが治療効果が認められた承認薬は無く、有効な治療薬の開発が切望されています。
当社は、2019年11月に京都府立医科大学との共同研究を開始しました。シャルコー・マリー・トゥース病の患者様の血液を用いて疾患特異的な疾患iPS細胞株を樹立し、神経系細胞の作製と病態再現による疾患モデルの開発と創薬応用を目指した研究開発を行っています。
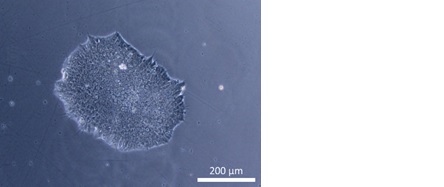
図6 疾患特異的iPS細胞の例
